|
Potentiometrie
Die Potentiometrie erfolgt durch eine pH
Elektrode mit der Anordnung:
Ag |AgCl
|KCl(3 mol) |Lösung II ||Lösung I |3 mol KCl |AgCl |Ag
als eine Potentialkette. Wobei Lösung
I eine Flüssigkeit mit konstantem Potential (Bezugspotential)
darstellt, und Lösung II die Flüssigkeit wo sich die Messelektrode
befindet (Messlösung). Durch den unterschiedlichen
Konzentrationsanteil von Lösung I und Lösung II entsteht eine
Potentialdifferenz. Diese Differenz ist gleichzeitig proportional
zum pH-Wert. Die Messelektrode besteht aus einem speziellen pH
selektiven Glas, sodass sie die Fähigkeit besitzt nur mit
Wasserstoffionen zu reagieren. Bei einer Messlösung mit einem
pH-Wert > 7 diffundieren mehrere Wasserstoffionen in die
Quellschicht und somit erhöht sich dadurch die Spannung. Die
Abhängigkeit von der Wasserstoffionen zur Spannung wird dabei mit
der Nernst Gleichung beschrieben:
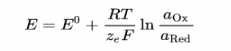
E: Elektrodenpotential, E^0 =
Standardpotential, R= Gaskonstante, T= Temperatur, ze= Anzahl der
übertragenen Elektronen, F = Faraday-Konstante, a= Aktivität
Die Abhängigkeit vom pH-Wert zu der Nernst
Gleichung ist wie folgt:
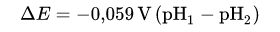
Bevor man überhaupt einen realistische
Spannung misst, muss ebenfalls eine Zweipunktkalibrierung (pH = 9
und ph = 4) durchgeführt werden, um Messfehler zu minimieren.
|